LA
TEORÍA ATÓMICA (II): LOS ÁTOMOS SON
DIVISIBLES Y AUNQUE SEAN DEL MISMO ELEMENTO , NO SIEMPRE IGUALES.
En este capítulo vamos a ver que el átomo no es indivisible tal y como propuseron los filósofos griegos y también Dalton en sus postulados. A finales del siglo XIX ya se presentía que tal afirmación no era cierta y no se sustentaba con las evidencias experimentales, sobre todo con la electricidad y sus leyes. En apenas 30 años se esclareció toda la estructura interna del átomo, descubriéndose las particulas que lo forman: Electrones, protones y neutrones. El descubrimiento de los isótopos acabó con la idea de que forzosamente todos los átomos de un mismo elemento eran iguales.
La existencia del electrón fue postulada por el físico irlandés G. Johnstone Stoney como la unidad de carga en los procesos de electrolisis que abedecen a las leyes de Faraday, y fue descubierto por Joseph John Thomson en el Laboratorio Cavendish de la Univeridad de Cambridge en 1897. En 1871 Stoney emitió la hipótesis de que tenia que existir una partícula que portara la menor cantidad de electricidad posible, la bautizó con el nombre de electrino y con ella pudo explicar correctamente las leyes de Faraday de la electrolisis entre otras cosas. En 1891 convencido ya de su existencia, la bautizó con el nombre de electrón (partícula portadora de la electricidad).
En 1897 Thomson, investigando los rayos catódicos, demostró que estaban formados por partículas más pequeñas que los propios átomos y cargadas electricamente. Los rayos catódicos se obtienen cuando en un tubo en el cual está encerrado un gas a muy baja resión se produce una fuerte descarga eléctrica. Se puede comprobar que aparece una luminiscencia que sale del cátodo (polo negativo) y se dirige al ánodo (polo positivo) de ahí el nombre de rayos catódicos. En realidad un tubo de descarga en un gas a baja presión es una cosa bastante familiar, los tubos fluorecentes que se usan para la iluminación, son tubos donde está encerrado un gas noble y dependiendo de este, la luminiscencia que se produce es distinta. También se han estado usado en los aparatos de televisión hasta hace bien poco, en estos aparatos antiguos la imagen se obtenía al poner una pantalla luiniscente cuando los rayos catódicos impactaban sobre ella.
En la época de Thomson ya era sabido que una carga eléctica al atravesa un campo magnético sufría una fuerza que era proporcional a su carga, tal fuerza es denominada fuerza de Lorentz. Al hacer atravesar los rayos catódicos un campo magnético, por efecto de esta fuerza los rayos se desviaban, de esa manera Thomson demostró que se trataban de partículas cargadas que no podían salir de otro sitio que de los propios átomos del gas encerrado en el tubo. Midiendo la desviacion sufrida fue capaz de averiguar la relación entre la carga y la masa de las partículas que constituían los rayos catódicos, encontrado un valor de 1,758796 1011 C/kg que era unas 2000 veces mayor que la que tenía el ión hidrógeno que era la partícula de tamaño atómico que más se desviaba de su trayectoria por efecto de un campo magnético, aunque lo hacía al contrario que los rayos catódicos (esto indicaba que su carga era de signo opuesto). Dado que no tenía mucho sentido el pensar que las partículas constituyentes de los rayos catódicos tuviera mil veces más carga que el ión, concluyó que debía de tener unas 2000 veces menos masa que el átomo más ligero que se conocía. De esta manera Thomson identificó al electrón como una partícula muy ligera que se necontraba en los átomos y que presentaba una carga eléctrica muy pequeña, de signo contrario al de los iones de hidrógeno.
En 1900 Robert Millikan comenzó una serie de experimentos que concluyeron en 1913 con la publicación de la medida experimental de la carga del eectrón. Su trabajo es conocido como el experimento de la "gota de aceite", y se basa en el hecho de que si se hace pasar una partícula carga por un campo eléctrico esta sufre una fuerza que es proporcional al valor de la carga que porta. Como partícula cargada uso gotas de aceite microscópicas producidas por un pulverizador y el rozamiento con el aire mientras se formaba la gota se ocupaba de cargarlas con una carga que sería n veces el valor de la carga eléctrica elemental (aclarando: una gota puede cargarse con 1,2,3,... o n cargas elementales, nunca con valores fraccionarios). Midiendo la aceleración con la que caían las gtas a traves de las placas de un condensador plano que originaba un campo eléctrico uniforme, podía obtener el valor de la carga eso si, haciendo miles de medidas. El valor que publicó fue de 1,592417 10-19 C que apenas se diferencia en un 1% del valor aceptado actualmente de 1,602176487 10-19 C. Esto nos indica que Millikan era un gran exerimentador pues el método empleado, distaba mucho de ser óptimo.
El resultado de Millikan posibilitó el conocer la masa del elctrón. Por la desviación de los rayos catódicos se había encntrado un valor para el cociente q/m del electrón. Si además se conoce el valor de q, determinar m es fácil, por ejemplo, tomando los valores de Thomson y Millikan, citados anteriormente, obtendríamos para la masa del electrón :
me
= 1,758796
1011C/kg
: 1,592417
10-19 C = 1,104482 10-30kg
que
es muy próximo al valor aceptado actualmente
de 9,109 382 91×10−31
kg para la masa de esta artícula. Si tenemos en cuenta que
nos
encontramos con valores experimentales de principios del siglo XX, uno
no tiene más remedio que rendir homenaje a los
físicos exerimentales de aquella época quienes,
con
medios muy escasos, desentrañaron la estriuctura del
átomo. Actualmente el símbolo del electrón es e o e-.
El protón
El protón (del griego πρῶτον, "primero") fue la segunda partícula fundmental en descubrirse. Eugene Goldstein a raiz del descubrimiento de Thomson, postuló la existencia de una partícula elemental cargada positivamente, dado que la materia en su estado normal es neutra. Anteriormente, había observado que si en un tubo de rayos catódicos se usaba un cátodo agujereado se observaban otros rayos que denominó "rayos canales o anódicos" que se dirigían al contrario que os rayos caódicos, esto es, viajaban del ánodo hacia el cátodo. Si éste se perforaba, los rayos podían atravesarlo y se observaba luminiscencia en la pared final del tubo. Los rayos canales estan formados por los iones positivos resultantes de los átomos del gas que se habían ionizanado por el choque de los electrones de los rayos catódicos con los átomos. Wien, mediante métoddos similares al de Thomson, determinó la relación q/m de distintos tipos de rayos canales. El valor más pequeño obtenido fue para el ión de hidrogeno, producido cuandoi el tubo estaba lleno de gas hidrógeno. Sin embargo, aunque hoy se sabe que los iones hidrógeno son en realidad protones, en aquel tiempo no era así y al ión hidrógeno se le concedía la propiedad de "ser la partícula atómica cargada positivamente más pequeña conocida".
En 1918 Rutherford, en el experimento que constituyó la primera reacción nuclear artificial que se hizo, encontró que al bombardear nitrógeno con partículas alfa (que ya vremos que son núcleos de helio) se obtenían iones de hidrógeno. Dado que el hidrógeno no estaa presente antes del bombardeo, concluyó que los iones hidrógeno estaban dentro del átomo de nitrógeno,y por eso, debería concebirse al ión citado como una partícula fundamental.
La masa del protón es 1,672621637 10−27kg , unas 1840 veces más grande que la del electrón y su carga es idéntica a la del electrón 1,602176487 10–19 C, pero de signo contrario. El símbolo del protón es p o p+.
Por convenio al tipo de carga que porta el electrón se le asigna signo negativo y a la que porta el protón signo negativo. Como la materia es neutra en su estado noral, el número de protones y electrones de un átomo debe ser el mismo. Por el contrario, un átomo con carga o ión, simplemente es un átomo que ha perdido o ganado electrones y por lo tanto, ha quedado cargado positiva o negativamente.
El neutrón
La masa de un átomo no podía explicarse solamente con dos tipos de partículas, el átomo de helio por ejemplo, debía contener unos cuatro protones y cuatroelectrones para poder satisfacer el valor de su masa (unas cuatro veces mayor que la de un átomo de hidrógeno) pero con este número de electrones, no se podía explicar que los iones de helio tuvieran como máximo carga +2 y que por tanto el átomo de helio no podía tener más que dos electrones. Una manera de soslayar el problema era suponer que había dos tipos de electrones, unos eran "arrancables" del átomo y otros no, porque estaban en el núcleo unidos a los protones de forma soidaria, formando unos extraños dipolos. Sin embargo tal hipótesis se demostró téricamente inviable, a distancias tan cortas las fuerzas de repulsión etre proptones y asimismo entre los electrones que estuvieran en el núcleo serían tan enormes que los núcleos se desintegrarían.

G. Jhonston Stone (1826-1911)y,
físico irlandés que postuló
la existencia del electrón.[5]


J.J. Thomson (1856-1940),
físico inglés, descubridor del
electrón y premio Nbel de Física en 1906 .[6]


Tubo
de rayos catódicos o tubo de Crookes. Se observa el tubo
donde
está encerrado el gas y los dos electrodos que
producen
las descarga que ioniza al gas. La cruz es en
realidad el electrodo positivo hacia el que se dirigen los rayos. que
salen del cátodo .[7]


El
mismo tubo en funcionamiento. La sombra de la cruz aparece en el fondo
del tubo, mientras que en el resto se observa la luminiscencia. [8]
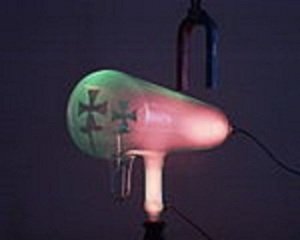

El
mismo tubo en funcionamiento, pero con un imán sobre
él.
Se observa como los rayos se desvían produciendo la sombra
de la
cruz desviada a la derecha.[9]


Robert Andrews Millikan (1868-1953), físico americano
ganador del
Nobel de Física en 1923. Determinó la
carga del
electrón, el valor de la constantede de Planck y
comprobó
la ley de Einsten del efecto fotoeléctrico, midiendo la
energía del fotón. [10]


Eugene Godsteiin(1850-1930)
descubridor de los rayos canales. [11]


Ernest
Rutherford (1875-1937), físico inglés, nacido en
Nueva
Zelanda . Fue galardonado con el Premio Nobel de Química en
1908 por sus trabajos en el campo de la radiatividad .[12]
Hubo que esperar hasta 1932 para que James Chadwick encontrara experimentalmente la primera evidencia de la existencia de esa partícula. Los procesos de fisión de un núcleo no parecían respetar leyes tan fundamentales como la Conservación del Momento Lineal , a menos que en dichos procesos se liberaran partículas de un tamaño aproximadamente igual al del proton, pero sin carga eléctrica. A la partícula descubierta se le dió el nombre de neutrón para indicar su carácter neutro. Su masa es 1,67492729 10−27 kg, es decir 1,00137 veces la masa del protón. Sin embargo, hay una diferencia radical entre protón y neutrón, el primero se cree que es totalmente estable, en cambio el segundo es inestable cuando se encuentra fuera del núcleo. El símbolo del neutrón es n o n0.

En 1911 Thomson encontró una utilidad muy importante a los rayos canales. Como la desviación de los rayos por la acción de un campo magnético dependía del valor de q/m, se le ocurrió que sie en el tubo había distintos gases, los rayos canales serían mezclas de distintos tipos de iones y la desviación sufrida en el campo magnético serviría para separarlos. En otras palabras, había encontrado la maner de separar átomos de distinta masa atómica. Si al final de la trayectoria de los iones separados se ponía una placa fotográfica, se obtenía por cada uno de ellos una raya al revelar la placa y obtener la fotografía.
En uno de los experimentos que realizó estando presente el gas neón entre otros, observó una pequeña anomalía en el resultado esperdo. La línea que correspondía al neón estaba formada por dos, muy próximas entre si. Rutherford concluyó ante este hecho que podía haber átomos del mismo elemento que tuvieran masa distintas. Había descubierto los isótopos, en concreto eran el 20Ne y el 22Ne , ambos átomos tienen el mismo número de protones 10, pero el primero tiene 10 neutrones y el segundo 12.
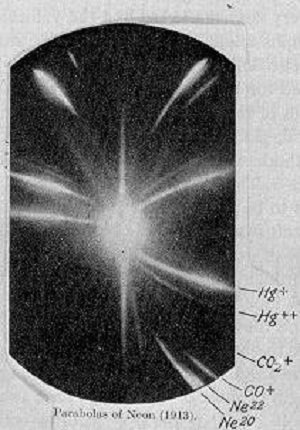
Placa
fotográfica que demostró la existencuia de los
isótopos. En la parte inferior derecha se observan dos
líneas curvas muy próximas que corresponden a los
isótopos Neón-20 y Neón-22 [14]