Los
descubrimientos del electrón y de la radiactividad natural
posibilitaron el comienzo de la ingente tarea de desvelar la estructura
y funcionamiento del átomo.
Esto cuajó en los primeros modelos
atómicos,
también llamados modelos clásicos que sin
embargo, se
revelaron como un gran fracaso pues no eran coherentes con los
resultados exerimentales. Uno
tras otro fueron desechados y cayeron en el olvido.
El descubrimiento del electrón llevó consecuentemente a la hipótesis de la existencia del protón para que de esa manera el átomo en su conjunto, fuera eléctricamente neutro. El modelo de Thomson para describirlo en pocas palabras consistía en pensar que elátomo era simplemente un conglomerado homogéneo cargado positivamente y de electrones más ligeros, que ocupaban los huecos dentro del conglomerado. Alguién comparó este modelo con un pudding de pasas ("plum pudding", en inglés) donde las pasas serían los electrones.
La verdad es que el modelo no despertó el más mínimo interés, ni describía la dinámica de las partículas que formaban el átomo, ni explicaba la ionización, menos la radiactividad y finalmente fue desechado. El experimento que vamos a relatar a continuación fue la puntilla que acabó con él definitivamente.
En 1911 Rutherford junto con sus colaboradores Geiger y Marsden, realizaron una serie de memorables experimentos para conocer cual era la estructura inrterna de los átomos. Anteriormente, habían observado al medir la penetración de las partículas alfa en la materia que cuando atravesaban una fina lámina de aluminio, algunas de las partículas salían en una dirección distinta de la inicial y que algunas, se podía decir, rebotaban, volvían hacia atrás.
Rutherford lanzó la hipótesis de que en el interior del átomo debería haber algo que produjera esa desviación y se propuso hacer el experimento en mejores condiciones y sobre todo, desarrolló toda la teoría necesaria para sacar conclusiones numéricas de su experimento y que actualmente se conoce como Teoría de la dispersión de Rutherford. En el experimento usaron un pan de oro, una lámina tan fina que hoy sabemos que no tendría más de 100 átomos de espesor y a la que bombardeaban con partículas alfa. Controlando el número de partículas emitida por la fuente radiactiva y midiendo los ángulos de desviación, llegaron a las siguientes conclusiones:
a) El átomo está
practicamente vacío, la mayoría de
las partículas lo atravesaban sin desviarse apenas.
b) En el átomo hay una zona interna (lo que llamamos núcleo) que contiene toda la carga positiva y practicamente toda su masa. Esto explica la fuerte desviación que sufrían algunas particulas, llegando algunas a rebotar cuando el choque era frontal.
Usando la teoría antes citada, estimaron el tamaño del núcleo en unos 10-15 m y el tamaño del átomo en alrededor de 10-10m. Además, el núcleo y el propio átomo, según sus conclusiones tendrían simetría esférica.
El experimento citado echó completamente por tierra el modelo de Thomson pues según éste, al estar la carga positiva distribuida de manera uniforme por todo el recinto atómico no produciría desviación alguna en las partículas alfa cargadas positivamente.
Simulación del esperimento de Rutherford, Geiger y Marsden
En el marco de abajo se representa una simulación del experimento de Rutherford, Geiger y Marsden. La figura del centro representa al átomo de oro que es bombardeado continuamente por partículas alfa. La desviación de estas es mayor cuanto más cerca del núcleo pasa y en algunos casos observarás que las partículas alfa retroceden. En los campo de texto en la parte inferior podrás leer el ángulo de deflexión (desviación respecto de la trayectoria original) que sufre la partícula al atravesar el átomo. Para comenzar la simulación haz "clic" sobre el átomo y para pararla, lo mismo.
b) En el átomo hay una zona interna (lo que llamamos núcleo) que contiene toda la carga positiva y practicamente toda su masa. Esto explica la fuerte desviación que sufrían algunas particulas, llegando algunas a rebotar cuando el choque era frontal.
Usando la teoría antes citada, estimaron el tamaño del núcleo en unos 10-15 m y el tamaño del átomo en alrededor de 10-10m. Además, el núcleo y el propio átomo, según sus conclusiones tendrían simetría esférica.
El experimento citado echó completamente por tierra el modelo de Thomson pues según éste, al estar la carga positiva distribuida de manera uniforme por todo el recinto atómico no produciría desviación alguna en las partículas alfa cargadas positivamente.
Simulación del esperimento de Rutherford, Geiger y Marsden
En el marco de abajo se representa una simulación del experimento de Rutherford, Geiger y Marsden. La figura del centro representa al átomo de oro que es bombardeado continuamente por partículas alfa. La desviación de estas es mayor cuanto más cerca del núcleo pasa y en algunos casos observarás que las partículas alfa retroceden. En los campo de texto en la parte inferior podrás leer el ángulo de deflexión (desviación respecto de la trayectoria original) que sufre la partícula al atravesar el átomo. Para comenzar la simulación haz "clic" sobre el átomo y para pararla, lo mismo.

Rutherford
en el acto de entrega del Premio Nobel. Su altura como
científico es comparable a la que tuvo como maestro de
científicos pues la mayoría de susu colaboradores
fueron
a su vez, premios Nobel. [21]
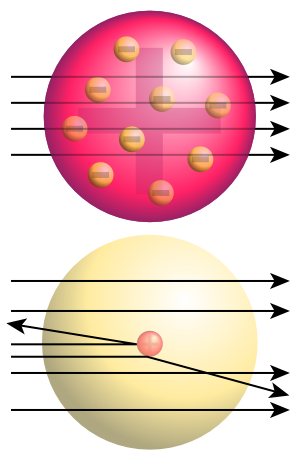
Comportamiento
de las partículas alfa al atravesar el átomo.
Según el átomo de Thomson (arriba) las
partículas
no se desviarían, sin embargo cuando se realizó
el
experimento se observó desviación e incluso el
"rebote",
de ahí que la carga positiva tenía que estar
concentrada
en el´centro del átomo. [22]
Observa atentamente la simulación y contesta a
las preguntas:
-¿Cuándo se produce la mayor deflexión de las partículas alfa?
-¿Porqué hay partículas que retroceden?
-¿Porqué las partículas que pasan lejos del núcleo no se desvían?
Anota en tu cuaderno el ángulo de deflexión de 50 partículas. ¿Con que frecuencia aparece un ángulo entre 10 y 20 grados?
Como conclusiones de su experimento, Rutherford propuso un nuevo modelo atómico. El átomo estaría dividido en os zonas de tamaño muy distinto el núcleo, que albergaba practicamente la masa del átomo y toda su carga positiva (los protones) y la corteza, formada por el conjunto de electrones. Los electrones se mantendríanían girando en órbitas alrededor del núcleo debido a la fuerza eléctrica de atracción entre cargas de distinto signo.
Este modelo es similar a la dinámica del movimiento planetario alrededor del Sol, o de los satélites alrededor de un planeta, en los que la fuerza atractiva es la fuerza gravitatoria.
El modelo "planetario" no fue propuesto por Rutherford en primer lugar, aunque si fue quién le dió base experimental. En realidad, en 1904 el científico japonés Nagaoka había propuesto un modelo similar denominado "saturnino" por asemejarse al planeta Saturno y sus anillos. El modelo de Nagaoka fue ignorado totalmente por la comunidad científica, pero en honor a la verdad, tiene el mérito de haber sido el primero en proponerlo.

Hantaro Nagaoka1865-1950),
fiísico
japonés, precursor del modelo planetario. [23]
Al modelo de Rutherford en seguida le sacaron grandes pegas. Todas ellas estaban basadas en la evidencia experimental y en las leyes físicas que se conocían por aquel entonces. En concreto pe eran las siguientes :
-No explicaba los espectros de emisión o absorción de los átomos. El estudio de los espectros lo dejaremos para el próximo capítulo.
-El átomo de Rutherford no podía ser estable. Según la teoría del electromagnetismo una carga eléctrica sometida a un movimiento periódico debería emitir ondas electromagnéticas, por ejemplo las ondas de radio que estaban recien descubiertas. Al emitir las ondas, el electrón perdería energía continuamente, por lo que la órbita cada vez tendría un radio menor y finalmente, caería sobre el núcleo positivo. En vez de una órbita, el electrón seguiría una espiral. Teniendo en cuenta esto, no habría un solo átomo en el Universo, por lo menos tal y como lo pensó Rutherford.
Como vamos a ver en el próximo capítulo la imposibilidad de explicar ciertos hechos experimentales condujo a la Física a un acllejón sin salida. Se imponía una revisión total de los fundamentos de esta ciencia.
Simulación
del modelo inestable de Rutherford. Los destellos azules representan
los fotones emitidos por el electrón en su movimiento
alrededor
del núcleo. Observamos como el movimiento es una espiral
hasta
que el electrón colapsa sobre el núcleo