Son propiedades que presentan los átomos de un elemento y que varían en la Tabla Periódica siguiendo la periodicidad de los grupos y periodos de ésta. Por la posición de un elemento podemos predecir qué valores tendrán dichas propiedades así como a través de ellas, el comportamiento químico del elemeneto en cuestión. Tal y como hemos dicho, vamos a encontrar una periodicidad de esas propiedades en la tabla. Esto supone por ejemplo, que la variación de una de ellas en los grupos o periodos va a responder a una regla general. El conocer estas reglas de variación nos va a permitir conocer el comportamiento, desde un punto de vista químico, de un elemento, ya que dicho comportamiento, depende en gran manera de sus propiedades periódicas.
Propiedades más importantes
Hay un gran número de propiedades periódicas. Entre las más importantes destacaríamos:
- Estructura electrónica
- Radio atómico
- Volumen atómico
- Potencial de ionización
- Afinidad electrónica
- Electronegatividad:
- Carácter metálico
- Valencia iónica
- Valencia covalente
- Radio iónico
- Radio covalente
Y también las siguientes propiedades físicas tienen una variación periódica:
- Densidad
- Calor específico
- Punto de ebullición
- Punto de fusión
Nosotros solamente vamos a describir las nueve primeras, pero en la Tabla Periódica interactiva de esta unidad encontrarás los valores de todas ellas correspondientes a cada elemento de la tabla.
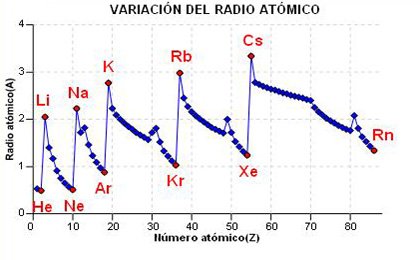
Radio atómico
Se define el radio atómico como la distancia más probable del electrón más externo al núcleo. Obsérvese que decimos distancia más probable, ya que según la mecánica cuántica, el electrón no se encuentra confinado en una órbita o trayectoria cerrada y solamente podemos hablar en términos de probabilidad de encontrar al electrón en un punto dado del espacio.
Conceptos próximos al de radio atómico son el de radio iónico y el de radio covalente que serían básicamente el mismo concepto indicado, salvo que se refiera a cuando el átomo está en forma de ión, en el primer caso, o formando una molécula diatómica con otro átomo igual en el segundo. Estas dos propiedades quedan fuera del alcance de nuestro propósito y por ello no hablaremos más.
De los datos experimentales que se conocen, se infiere que el radio atómico disminuye a lo largo de un periodo y por el contrario aumenta al descender en un grupo de la Tabla Periódica. Parece que esto es un contrasentido pues es de esperar que al aumentar Z, el átomo al poseer más electrones aumente de tamaño y que por tanto a mayor Z, mayor radio.
La explicación no es sencilla, tiene que ver con lo que se denomina "efecto pantalla" que, para explicarlo en términos fáciles de entender, no es otra cosa que el efecto que causan los electrones más internos en el electrón más externo. Hay que pensar que el electrón está sometido a la fuerza de atracción proveniente del núcleo y a la de repulsión debido a los otros electrones que tiene el átomo. Cuando estos electrones están en orbitales más internos (los que tienen n menor) el efecto es mayor que cuando residen en orbitales tan externos como el del electrón al que repelen.
Veamos primeramente la variación en un periodo. Cojamos para aclarar el segundo periodo que empieza con el Li=1s22s1 y que acaba con el Ne=1s22s22p6. Si nos fijamos, los siete electrones de diferencia que hay entre uno y otro, se han ido incluyendo en orbitales s o p con el mismo número cuántico principal (n=2), estos nuevos electrones son poco apantallantes y repelen poco al electrón más externo, mientras que el núcleo, de uno a otro elemento, ha aumentado en 8 protones. En el balance, la atracción nuclear supera a la repulsión electrónica por eso el radio disminuye.
En un grupo sucede lo contrario. Tomemos como ejemplo el primer grupo de la tabla periódica. Del H Z=1, al Ra Z=88, el núcleo adquiere 87 protones, pero los 87 electrones han ido ocupando orbitales más internos (dede n=1 hasta n=6) ocasionando un gran efecto pantalla. En el balance, la repulsión es muy grande frente a la atracción nuclear y esto permite que ese electón más externo esté poco atraído por el núcleo y por tanto el radio atómico aumente.
En la siguiente actividad interactiva podemos apreciar lo anteriormente dicho.
a) En el gráfico de la derecha tienes representada la variación del radio atómico frente al número atómico. Puedes observar como desde el metal alcalino hasta el gas noble (periodo) el radio atómico disminuye. Por el contrario, si observas la variación de un grupo, por ejemplo el de los gases nobles, el radio va aumentando.
b) Selecciona un periodo (grupo) y haciendo click en el botón, te aparecera el gráfico de la variación del radio atómico en ese periodo (grupo).
El valor del radio atómico viene medido en armstrongs(Å), 1Å=10-10m.
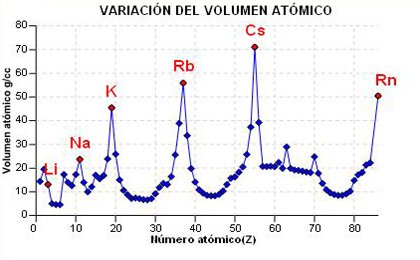
El
volumen atómico se define como la masa molecular dividida
por la densidad y se suele expresar en cm3/mol. Es
fácil:
V=M/d
(g/mol : g/cm3= cm3/mol)
En
el
caso de sustancias gaseosas se toma la densidad y el punto de
ebullición ya que la densidad de un gas cambia mucho con la
temperatura. En realidad, el volumen atómico representa el
volumen de un mol de átomos del mismo elemento. La
variación en la Tabla Periódica
es similar a la del radio atómico, y las razones son las
mismas que para el caso del radio atómico, por ello no nos
extenderemos más.
a) En el gráfico de la derecha tienes representada la variación del volumen atómico frente al número atómico. Puedes observar como aumenta en un grupo y disminuye a lo largo de un periodo (con alguna excepción).
b) Selecciona un periodo (grupo) y haciendo click en el botón, te aparecera el gráfico de la variación del volumen atómico en ese periodo (grupo).
Se define el potencial de ionización como la energía que debemos suministrar a un átomo para arrancarle un electrón. Esquemáticamente, para un átomo A cualquiera, podemos escribir:
A + PI
= A+ + e-
donde PI
representaría la energía a suministrar. El
potencial de ionización nos mide la "facilidad" con la que
un átomo neutro se puede convertir en un ión
positivo (catión). En teoría, el
proceso puede repetirse y las cantidades de energía
necesarias se llamarían segundo potencial de ionización, tercer... etc.
La energía que habrá que suministrar al
electrón para que pueda escapar del
átomo tendrá que ver con la mayor o
menor fuerza con la que es atraído por el núcleo y repelido
por los otros electrones, y esta a su vez depende del número
de protones (Z) y de la repulsón de los otros electornes
sobre el que se va a arrancar. En definitiva volvemos a lo mismo: al
efecto pantalla.
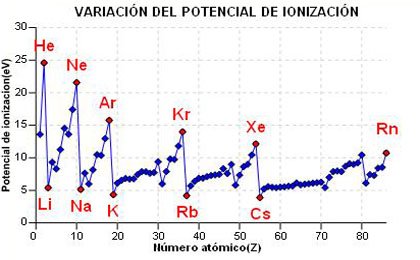
Después de lo dicho, la cosa queda clara. Según
bajamos en un grupo el efecto pantalla aumenta, como ya vimos en el
caso del radio atómico y, por tanto, según bajamos
en un grupo, el potencial de ionización
disminuye. Por el contrario,
a lo largo del periodo, el efecto pantalla disminuye y por
tanto, a lo largo de un
periodo, el potencial de ionización aumenta.
Según esto, los elementos cuanto más a la
izquierda y más abajo estén situados en la Tabla
Periódica (los metales) mayor facilidad tendrán
de formar iones positivos.
a) En el gráfico de la derecha tienes representada la variación del potencial de ionización frente al número atómico. Puedes observar como disminuye en un grupo y aumenta a lo largo de un periodo (con alguna pequeña excepción).
b) Selecciona un periodo (grupo) y haciendo click en el botón, te aparecera el gráfico de la variación del volumen atómico en ese periodo (grupo).
El valor del potencial viene expresado en electrón-voltios(eV), unidad de energía muy usada en física nuclear, 1eV=1,610-19J.
La electroafinidad o afinidad electrónica se define como la energía desprendida en el proceso mediante el cual un átomo captura un electrón, convirtiéndose en un ión negativo (anión). Podríamos representar el proceso mediante la ecuación:
A + e- =
A- + Ea
siendo
Ea la electroafinidad. El proceso es justamente el
contrario al que
vimos en el caso del potencial de ionización. Este
último era un proceso
endoérgico (consume energía), por el
contarrio el proceso que nos ocupa sería exoérgico
(desprende energía) y por tanto, según el principio de
mínima energía, cuanto mayor sea la
energía desprendida, más estable será
el producto (ión) formado. En defnitiva, a mayor
electroafinidad, mayor tendencia a formar iones negativos
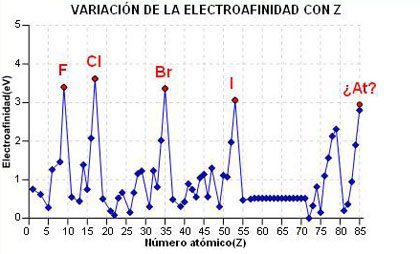
Para comprender la variación en la Tabla Periódica, debemos hacer el razonamiento contrario al que hicimos en el caso del potencial de ionización, cuanto menor es el efecto pantalla, mayor será la repulsión sufrida por el nuevo electrón y viceversa. Por tanto, está claro que la electroafinidad disminuye al bajar en un grupo y aumenta a lo largo de un periodo.
Según esto, los elementos que presentan mayor tendencia a formar iones negativos estarán situados arriba y a la derecha de la Tabla Periódica.
Para comprender la variación en la Tabla Periódica, debemos hacer el razonamiento contrario al que hicimos en el caso del potencial de ionización, cuanto menor es el efecto pantalla, mayor será la repulsión sufrida por el nuevo electrón y viceversa. Por tanto, está claro que la electroafinidad disminuye al bajar en un grupo y aumenta a lo largo de un periodo.
Según esto, los elementos que presentan mayor tendencia a formar iones negativos estarán situados arriba y a la derecha de la Tabla Periódica.
Actividad VIII: visualiza la variación
de la electroafinidad en la Tabla Periódica.
a) En el gráfico de la derecha tienes representada la variación de la electroafinidad frente al número atómico. Puedes observar como disminuye en un grupo y aumenta a lo largo de un periodo (con alguna pequeña excepción).
b) Selecciona un periodo (grupo) y haciendo click en el botón, te aparecera el gráfico de la variación del volumen atómico en ese periodo (grupo).
El valor de la electroafinidad viene expresado en eV.
a) En el gráfico de la derecha tienes representada la variación de la electroafinidad frente al número atómico. Puedes observar como disminuye en un grupo y aumenta a lo largo de un periodo (con alguna pequeña excepción).
b) Selecciona un periodo (grupo) y haciendo click en el botón, te aparecera el gráfico de la variación del volumen atómico en ese periodo (grupo).
El valor de la electroafinidad viene expresado en eV.
La electronegatividad se define como una propiedad que nos mide la atracción que ejerce un átomo sobre los electrones del enlace. Es por tanto, una propiedad que no se refiere al átomo aislado, sino al átomo enlazado y más concretamente, cuando está enlazado de manera covalente (compartiendo electrones con otro). Es claro que aquellos átomos que tienen tendencia a capturar electrones (electroafinidades altas) y poca tendencia a formar iones positivos (potenciales de ionización altos) serán más electronegativos. Por eso, en 1930, Mulliken estableció una fórmula para calcular la electronegatividad relacionada con los valores de la electroafinidad y del potencial de ionización. La fórmula es:
En=(PI+Ea)/2
Sin
embargo el hecho de que no se conozcan experimentalmente el valor de
las electroafinidades de muchos átomos hace que esta
fórmula sea poco práctica, por ello, el
científico americano Linus Pauling (ganador de dos Nobel,
uno de ellos Nobel de la Paz) propuso una escala basada en
consideraciones teóricas que se escapan de los objetivos de
este capítulo. La escala va de 0 a 4, el valor 4
representaría el máximo (el flúor
según esta escala es 3,98) y el 0 sería el
mínimo (gases nobles como el helio).
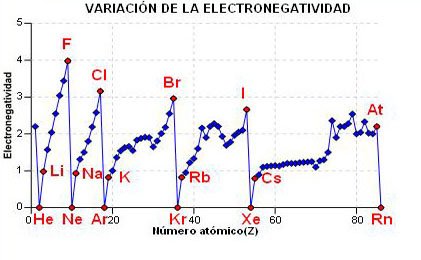
La variación de la electronegatividad estará de acuerdo a como lo hacen el potencial de ionización y la electroafinidad. A medida que bajamos en un grupo disminuyen el PI y la Ea y por tanto disminuye la electronegatividad. Por el contrario, cuando avanzamos en el periodo tanto el PI como la Ea aumentan, por tanto la electronegatividad aumentará.
Cuanto más a la derecha y más arriba en la Tabla Periodica mayor será la electronegatividad, por ello la electronegatividad más alta corresponde a los no metales.
La variación de la electronegatividad estará de acuerdo a como lo hacen el potencial de ionización y la electroafinidad. A medida que bajamos en un grupo disminuyen el PI y la Ea y por tanto disminuye la electronegatividad. Por el contrario, cuando avanzamos en el periodo tanto el PI como la Ea aumentan, por tanto la electronegatividad aumentará.
Cuanto más a la derecha y más arriba en la Tabla Periodica mayor será la electronegatividad, por ello la electronegatividad más alta corresponde a los no metales.

Linus
Pauling (1901-1994) En la foto aparece jovencito y
recién
grduado , después ganaría el premio Nobel de
Química y, el premio
Nobel de ¡la Paz! (saber
más)

Robert
S. Mulliken (1896-1986)
a) En el gráfico de la derecha tienes representada la variación de la electronegatividad frente al número atómico. Puedes observar como disminuye en un grupo y aumenta a lo largo de un periodo.
b) Selecciona un periodo (grupo) y haciendo click en el botón, te aparecera el gráfico de la variación del volumen atómico en ese periodo (grupo).
La valencia iónica es la valencia que presenta un elemento cuando forma un compuesto iónico. En un compuesto iónico los átomos están en forma iónica y en su conjunto, la sustancia tiene que ser neutra, con lo que la suma de las cargas positivas y negativas debe ser cero, por eso las cargas de los iones y las proporciones de éstos deben estar en consonancia con la regla que hemos dado de neutralidad. Por ejemplo en NaCl, hay un átomo de sodio por cada átomo de cloro, la carga de cada sodio debe ser la de cada átomo de cloro, pero de signo contrario, en concreto, el sodio forma iones Na+ y el cloro iones Cl -, por lo que podemos decir que el electrón que pierde el sodio lo gana el cloro. Por nuestros conocimientos de formulación, sabemos que en ese compuesto la valencia de ambos es 1, la conclusión es evidente:
- La valencia iónica coincide en valor absoluto con la carga del ión.
Otra cosa distinta es explicar por qué el sodio y el cloro forman esos iones, para ello escribamos las configuraciones de ambos elementos:
[Na] = 1s2 2s22p63s1 [Na+] = 1s2 2s22p6
[Cl] = 1s2 2s22p63s23p5 [Cl-] = 1s2 2s22p63s23p6
Observamos que tanto el ión sodio como el ión cloruro adoptan la configuración de un gas noble, el neón para el primero y el argón para el segundo.
Podemos decir que la tendencia de un átomo a formar un ión determinado tiene que ver con que el ión tenga una configuración estable y que en muchos casos esta coincide con la del gas noble anterior para los iones positivos y con el gas noble posterior cuando el ión negativo.
De todo lo dicho podemos deducir que:
-Los elementos de un mismo grupo forman iones con la misma carga. Por ejemplo: los alcalinos +1, los alcalinotérreos +2, los anfígenos -2, los halógenos -1, etc.
La valencia covalente es la valencia con la que actúa un elemento en un compuesto de tipo covalente. El enlace covalente se forma cuando los dos átomos implicados (elementos no metálicos) comparten electrones. Al compartir electrones los átomos consiguen mayor estabilidad que cuando están aislados, por tanto buscarán tener la configuración electrónica lo más estable posible, esto es, la de un gas noble. La discusión completa se sale de los objetivos de este capítulo y es mejor reservarla para el capítulo que destinaremos al enlace.
En una molécula diatómica la valencia covalente equivale al número de electrones que aporta el átomo para formar el enlace. Tomemos como ejemplo la molécula de SO en la cual, tanto el azufre como el oxígeno actúan con valencia 2, la configuración de la capa de valencia (la de n más alto) es respectivamente 2s22p4 para el oxígeno y 3s23p4 para el azufre. En ambos casos, si el átomo consigue dos electrones más al compartir llegarían a la configuración del gas noble inmediato en la Tabla Periódica. Según esto la valencia covalente no sería otra cosa que el número de electrones que debe compartir el átomo para alcanzar la configuración de un gas noble (no se cumple siempre, sobre todo en moléculas poliatómicas, pero esto lo dejaremos para cuando hablemos del enlace covalente).
De todo lo dicho podemos deducir que:
- Elementos del mismo grupo tendrán la misma valencia covalente fundamental (la más frecuente).
- La valencia covalente aumenta en un periodo entre los elementos no metálicos. Así por ejemplo: C(4), N(3), O(2) y F(1).