Antededentes
Fue Niels Bohr, físico danés quien ya ha aparecido anteriormente como precursor de la Tabla Periódica actual basada en su teoría del átomo, el que en 1923 ya indicó que las propiedades periódicas debían de relacionarse con la distribución de los electrones en niveles de energía dentro de cada tipo de átomo. Hoy en día sabemos que esto es así, pero que solamente la teoría cuántica del átomo da una respuesta satisfactoria a la distribución de los electrones en niveles de energía, lo que actualmente llamamos configuración electrónica.
La configuración electrónica de un átomo y las reglas para establecerla.
Podemos definir la configuración electrónica como la distribución de los electrones de un átomo, ordenados de menor a mayor energía según capas o niveles y subniveles. La configuración electrónica de un elemento se establece mediante unas reglas que derivan de cálculos teóricos. Para ello, debemos tener en cuenta algunos resultados del modelo cuántico del átomo que ya hemos estudiado anteriormente.
I) El número de electrones de un átomo neutro es igual al de protones en su núcleo, por tanto igual a Z.
II) Los electrones ocuparán los orbitales atómicos de menor a mayor energía hasta llenarlos, cumpliendo con el pricipio de exclusión de Pauli (2 electrones = nº máximo de ocupación en cada orbital).
III) El orden de llenado de los orbitales es:
1s<2s<2p<3s<3p<4s<3d<4p<5s<4f<5d<6p<7s<5f<6d<7p...
Es importante darse cuenta de que la ordenación en energías no sigue exactamente el orden del número cuántico principal (n), por ejemplo: 4s<3d. La razón es que la energía de un orbital no depende solamente del valor de n, sino también del número cuántico secundario l, una buena regla para no confundirse sería la siguiente:
IV) El orbital con menor energía es el que tenga la suma n+l menor.
En efecto, para 4s sería 4+0=4 y para 3d 3+2=5, luego 4s<3d. Una buena solución para no confundirse, es utilizar el diagrama de Moeller, que nos indica mediante flechas el orden correcto empezando por el orbital de menor energía: el 1s
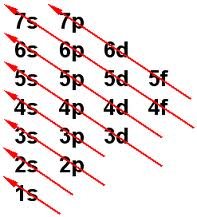
Diagrama de
Moeller
De todas formas
esta regla tiene alguna excepción, pues para algunos elementos
no se cumple a rajatabla y su configuración electrónica,
aunque muy próxima, difiere algo de la obtenida mediante las
reglas que hemos dado. Son las denominadas anomalías y tiene
justificación tanto teórica como experimentalmente.
Creemos que nos saldríamos un poco de los objetivos que nos
hemos propuesto y por ello, no discutiremos más sobre estas
anomalías aunque, las más importantes las
señalaremos en su momento.Construyendo la configuración de cada elemento
Empecemos con el hidrógeno, Z=1, solamente un electrón que tendrá que ir al orbital más bajo en energía el 1s. Escribimos:
[H] = 1s1
El siguiente elemento es el helio, Z=2. Este segundo electrón cabe también en el 1s, pondremos por tanto:
[He] = 1s2
Hemos llenado el orbital 1s, pero también hemos completado la capa K (n=1). Esto nos explica por qué en el primer periodo de la tabla solamente hay dos elementos.
Los paréntesis cuadrados entre los que encerramos el símbolo, nos indican que nos referimos a su configuración electrónica.
El siguiente elemento es el Li, Z=3, el nuevo electrón irá a parar a la siguiente capa (n=2) y en ella al orbital de menor energía que es el 2s. Por tanto:
[Li] = 1s2 2s1
En el siguiente elemento, el berilio, se llena el orbital 2s
[Be] = 1s2 2s2
Para el boro, Z=5, el nuevo electrón ocupa uno de los orbitales p, cualquiera de ellos, pues todos tienen la misma energía:
[B] = 1s2 2s22p1
A partir de ahí se van llenando progresivamente los tres orbitales p:
[C] = 1s2 2s22p2
[N] = 1s2 2s22p3
[O] = 1s2 2s22p4
[F] = 1s2 2s22p5
[Ne] = 1s2 2s22p6
Del litio al neón hemos llenado la capa L (n=2) , en total, en la capa, caben ocho electrones, de ahí que en el segundo periodo de la tabla solamente haya ocho elementos. Con el neón se cierra la capa al igual que ocurrió antes con el helio.
Con el Na, comenzamos a llenar la capa M (n=3), primeramente el orbital 3s y después los tres orbitales 3p, al llegar argón, no se completa la capa del todo (n=3, en total: 18 electrones)
[Na] = 1s2 2s22p63s1
[Mg] = 1s2 2s22p63s2
[Al] = 1s2 2s22p63s23p1
[Si] = 1s2 2s22p63s23p2
[P] = 1s2 2s22p63s23p3
[S]= 1s2 2s22p63s23p4
[Cl] = 1s2 2s22p63s23p5
[Ar] = 1s2 2s22p63s23p6
Al llegar al argón hemos completado el tercer periodo de la tabla, pero no la tercera capa (M) correspondiente a n=3, la cual se llena con 18 electrones ¿Dónde están esos diez elementos que faltan aparentemente en el tercer periodo? La respuesta es simple: esos diez elementos no pertenecen al periodo tercero sino al cuarto, corresponderían a configuraciones en las cuales el último electrón ocupa uno de los 5 orbitales 3d. Las cuentas salen, 5 orbitales a dos electrones en total: diez. Sin embargo, recordando la regla de la energía, deberemos llenar antes el orbital 4s (n+l=4+0=4) que el 3d (n+l=3+2=5). Por tanto, esos diez elementos que nos faltan, que se asimilan al llenado de los orbitales 3d, corresponderán al cuarto periodo (n=4) y no al tercero.
Ateniéndonos a lo que hemos dicho anteriormente, los dos elementos siguientes (K y Ca, Z=19 y Z=20) tendrán por configuraciones las siguientes:
[K] = [Ar] 4s1
[Ca] = [Ar] 4s2
Donde estamos usando una notación abreviada, a lo que hemos puesto en negrita hay que añadir la configuaración del gas noble anterior, en este caso el argón. El siguiente elemento, el Sc( Z=21), tendrá por configuración:
[Sc] = [Ar] 3d14s2
A partir de ahí vamos completando sucesivamente los orbitales 3d (nivel l=2) de la capa anterior
[Ti] = [Ar] 3d24s2
[V] = [Ar] 3d34s2
[Cr] = [Ar] 3d44s2 ( [Ar] 3d54s1, se trata de una anomalía)
[Mn] = [Ar] 3d54s2
[Fe] = [Ar] 3d64s2
[Co] = [Ar] 3d74s2
[Ni] = [Ar] 3d84s2
[Cu] = [Ar] 3d94s2 ([Ar] 3d104s1, se trata de una anomalía)
[Zn] = [Ar] 3d104s2
Con el Zn hemos completado el llenado de los orbitales 3d y concluido lo que se denomina una serie de transición. En los siguientes elementos, del galio al kriptón, se sigue normalmente, esto es, vamos llenando los orbitales 4p:
[Ga] = [Ar] 3d104s24p1
[Ge] = [Ar] 3d104s24p2
[As] = [Ar] 3d104s24p3
[Se] = [Ar] 3d104s24p4
[Br] = [Ar] 3d104s24p5
[Kr] = [Ar] 3d104s24p6
En el quinto periodo (n=5) la estructura es similar, primeramente llenaremos el orbital 5s, seguidamente el 4d y por último el 5p. Las configuraciones de los 18 elementos que forman el periodo quedarían así:
[Rb] = [Kr] 5s1
[Sr] = [Kr] 5s2
[Y] = [Kr] 4d15s2
[Zr] = [Kr] 4d25s2
[Nb] = [Kr] 4d35s2
[Mo] = [Kr] 4d45s2 ( [Kr] 4d55s1)
[Tc] = [Kr] 4d55s2
[Ru] = [Kr] 4d65s2
[Rh] = [Kr]4d75s2
[Pd] = [Kr]4d85s2
[Ag] = [Kr] 4d95s2 ([Kr] 4d105s1)
[Cd] = [Kr] 4d105s2
[In] = [Kr] 4d105s25p1
[Sn] = [Kr] 4d105s25p2
[Sb] = [Kr] 4d105s25p3
[Te] = [Kr] 4d105s25p4
[I] = [Kr] 4d105s25p5
[Xe] = [Kr] 4d105s25p6
Podemos observar que en este periodo no hemos llenado ni el orbital 4f, ni el 5d, lo cual ocurrirá en el periodo siguiente. Siguiendo la regla que hemos dado anteriormente, el orden de llenado para el sexto periodo (n=6) será: 6s<4f<5d<6p. El llenado del orbital 4f (14 electrones) origina una nueva serie de transición, denominada en este caso serie de transición interna, formada por 14 elementos que constituyen la familia de los lantánidos. Los 32 elementos que forman el sexto periodo tendrían las siguientes configuraciones:
[Cs] = [Xe] 6s1
[Ba] = [Xe] 6s2
[La] = [Xe] 5d16s2
A partir del lantano (que no cumple esrictamente la regla ya que hemos llenado 5d antes que 4f) tendremos la serie de transición interna formada por 14 elementos. Vamos llenando correlativamente desde el cerio al lutecio, el orbital 4f.
Ce = [Xe] 4f2 6s2
...
Lu = [Xe] 4f145d1 6s2
Esto es un poco lioso. En realidad todavía se discute si el primer elemento de transición es el lantano o el lutecio y por tanto, el primer elemento de la transición interna sería el lantano y el cerio el segundo. Las razones se escapan de los objetivos de este curso, así como otras pequeñas anomalías que ocurren en la serie de transición, al no respetarse la regla que hemos dado para el llenado de los orbitales.
A partir del hafnio y hasta el mercurio, vamos llenando el orbital 5d, solamente tenemos una anomalía: la correspondiente al oro. Tendríamos entonces:
Hf = [Xe] 4f145d26s2
...
[Au] = [Xe] 5d96s2 ([Xe] 5d106s1)
Hg = [Xe] 4f145d106s2
En los sucesivos elementos, desde el talio al radón, vamos llenando correlativamente el orbital 6p, esto es:
Tl = [Xe] 4f145d10 6s26p1
...
Rn = [Xe] 4f145d10 6s26p6
Con el radón concluye el sexto periodo. En lo que respecta al séptimo , la estructura es semejante. En este caso, el orden de llenado sería 7s<5f<6d<7p, aunque hay más anomalías que en el periodo anterior (en los actínidos concretamente). Con atender a la regla de llenado que hemos dado tenemos suficiente para cumplir los objetivos de este curso y no nos detendremos más.
Configuración, grupo y periodo.
Con lo que hemos visto hasta ahora es suficiente para darnos cuenta de que la configuración electónica de cada elemento determina la posición de éste en la Tabla Periódica. Todos los elementos que tienen una ocupación semejante de los orbitales de la última capa forman un grupo, es decir, un conjunto de elementos que tienen un comportamiento desde el punto de vista químico semejante. Por ejemplo: todos los metales alcalinos tienen una ocupación s1 , los alcalinotérreos s2, los halógenos s2p5 etc. De todo esto podemos deducir que el comportamiento químico de un elemento está determinado por la configuración electrónica más externa (lo que llamaremos electrones de valencia).
Los periodos están formados por el conjunto de elementos en los que la última capa que se va completando es la misma. Podemos decirlo de otra manera, los elementos de un periodo tienen sus electrones más externos situados en orbitales con el mismo número cuántico y que a su vez, corresponde con el número de orden del periodo. Por ejemplo: Na (3s1) y Ar (3s23p6), n=3 o tercer periodo. Ca(4s2) y Ge(4s24p2), n=4 o cuarto periodo.
Todo esto que hemos explicado se puede visualizar , haciendo la siguiente actividad interactiva.
Actividad
interactiva III: Configuraciones electrónicas
a) Usa los botones de la tabla (etiquetados s1...p6) para ver la relación entre la configuración electrónica y el grupo.
b) Pasa el cursor del ratón por los elementos de los periodos (de izquierda a derecha) de la tabla para ver el cumplimiento de la regla orden del periodo = n más alto ocupado).
a) Usa los botones de la tabla (etiquetados s1...p6) para ver la relación entre la configuración electrónica y el grupo.
b) Pasa el cursor del ratón por los elementos de los periodos (de izquierda a derecha) de la tabla para ver el cumplimiento de la regla orden del periodo = n más alto ocupado).
Las configuraciones que hemos construido representan al átomo en sus estado de mínima energía. Esto quiere decir que es la forma más estable o también llamado estado fundamental; pero por razones tales como la absorción de energía electromagnética o al interaccionar con otros átomos para formar enlace, un átomo puede adoptar una configuración de mayor energía, no estable, que se denomina estado excitado. Un átomo excitado tiende a volver a su estado fundamental desprendiéndose, en forma de energía electromagnética, del exceso de energía que tiene.
Un átomo en un estado excitado tendrá una configuración que no respeta las reglas que hemos dado. Ni más ni menos, consiste en promocionar electrones a orbitales vacíos de energía superior. Por ejemplo:
[He] = 1s2 [He*] = 1s1 2s1 [He*] = 1s1 2p1
El asterisco que ponemos al símbolo, indica que el átomo de helio no está en su estado normal, sino que es un átomo excitado.
Configuración de un ión
Para encontrar la configuración electrónica de un ión basta con hacer la configuración electrónica del élemento que tendría el mismo número de electrones. Por ejemplo:
[Na] = 1s2 2s22p63s1 [Na+] = 1s2 2s22p6
[Cl] = 1s2 2s22p63s23p5 [Cl-] = 1s2 2s22p63s23p6
En el primer caso, al quitar un electrón al sodio, el ión resultante tendrá el mismo número de electrones que el neón, y en el segundo caso, al añadir un electrón al cloro, el ión cloruro tendrá la misma configuración que el argón.
Dos átomos que tienen el mismo número de electrones y por tanto la misma configuración, se denominan isoelectrónicos.